Einhaltung der UDI Vorschriften durch modulare und flexible Technologien
Abzweigungen sowie Fälschungen von Produkten verursachen jährlich Umsatzeinbußen in Höhe von mehreren Millionen Euro. Die Umsetzung der neuesten UDI Vorschriften gemäß der Medizinprodukteverordnung (EU MDR 2017/745) ist daher von besonderer Bedeutung. Im internationalen Warenverkehr sind diese Vorschriften zwingende Voraussetzungen, um Missbrauchsrisiken zu reduzieren und mehr Transparenz sowie einen besseren Datenaustausch zwischen allen Beteiligten zu gewährleisten.
Die Umsetzung stellt die Hersteller von Medizinprodukten kurzfristig vor verschiedene Herausforderungen. Zudem bringt sie teils erhebliche Kosten sowie Organisationsschwierigkeiten mit sich. Dennoch generiert die Rückverfolgbarkeit von Medizinprodukten über ein Unique Device Identification System langfristig auch potenzielle Profite, da Fälschungen eingedämmt, Parallelimporte verhindert und die Kontrolle bzw. Transparenz der Daten verbessert werden.
Whitepaper: Zukunftssichere Compliance: Unique Device Identification aus weltweiter Perspektive
Schneller Zugriff auf Produktinformationen, verbessertes Rückrufmanagement, höherer Schutz vor Fälschungen und Graumärkten - Die Unique Device Identification (UDI) medizinischer Geräte wird aller Voraussicht nach die Medizinproduktebranche revolutionieren. Gleichzeitig wirft sie zahlreiche neue Fragen auf und ruft bei Produktherstellern und Kennzeichnungsunternehmen verschiedene Bedenken hervor. Die globale Perspektive darf nicht aus den Augen verloren werden, wobei alle Entwicklungen und Veränderungen im Zusammenhang mit UDI berücksichtigt werden müssen.
Informieren Sie sich in diesem Whitepaper über die Herausforderungen und Erfolgsfaktoren der UDI-Implementierung aus globaler Sicht. Das Dokument bietet Produktherstellern und Kennzeichnungsunternehmen einen globalen Überblick über die neuesten Entwicklungen auf internationaler Ebene. Als solche ist es eine wertvolle Informationsquelle für internationale Produkthersteller und Kennzeichnungsunternehmen.
Die Grundlagen des Unique Device Identification Systems der EU
Bei der Umsetzung der UDI Vorschriften der neuen Medizinprodukteverordnung und der Einhaltung ihrer Fristen durchlaufen die Unternehmen der Branche zunächst eine Implementierungsphase. In dieser Phase statten sie ihre Verpackungsstraßen mit den neuen Technologien aus und implementieren zusätzliche IT-Lösungen. Nach der EU Medizinprodukteverordnung (MDR/IVDR) sind die Produzenten dabei selbst für die korrekte Umsetzung der folgenden Maßnahmen verantwortlich:
Vergabe von eindeutigen Unique Device Identifier
Mit nur wenigen Ausnahmen muss jedem Medizinprodukt, das auf den Markt kommt, eine UDI (auch: Produktidentifizierungsnummer) zugewiesen werden, die sich folgendermaßen zusammensetzt:
- eine Produktkennung (UDI-DI) mit spezifischen Informationen über den Hersteller und das Produkt
- eine Herstellerkennung (UDI-PI) mit den variablen Produktionsdaten wie der Serien- oder Chargennummer, dem Zeitraum der Herstellung und dem Verfallsdatum
Die UDI Vorschriften der Medizinprodukteverordnung verpflichten die Hersteller allerdings nicht zum Generieren der UDI-DI (siehe oben), denn diese erhalten sie von einer der zuständigen Behörden (GS1, HIBCC, ICCBBA oder IFA), die sie selbst auswählen können.
Anbringung des UDI Codes auf dem Produkt und der Verpackung
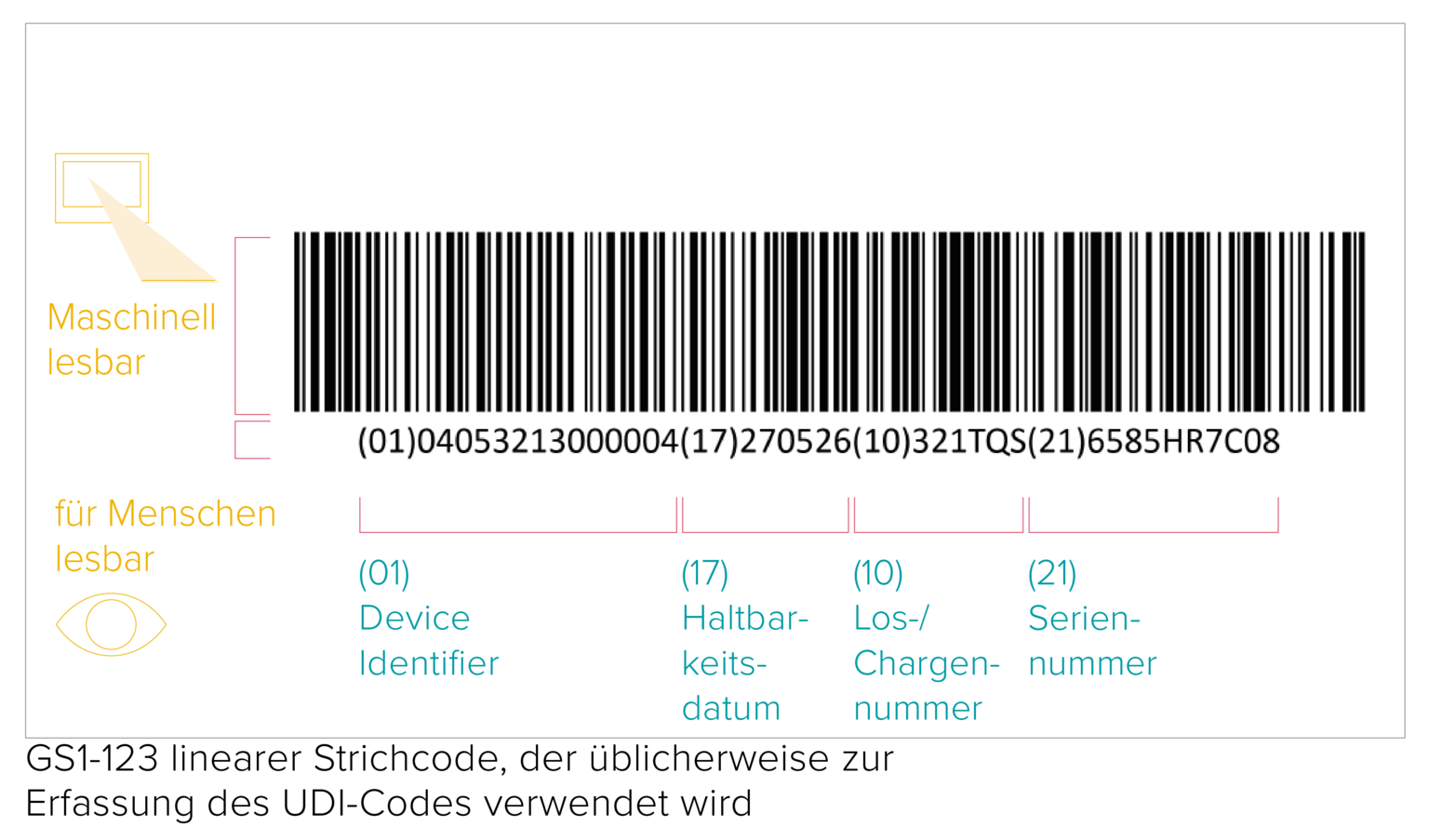
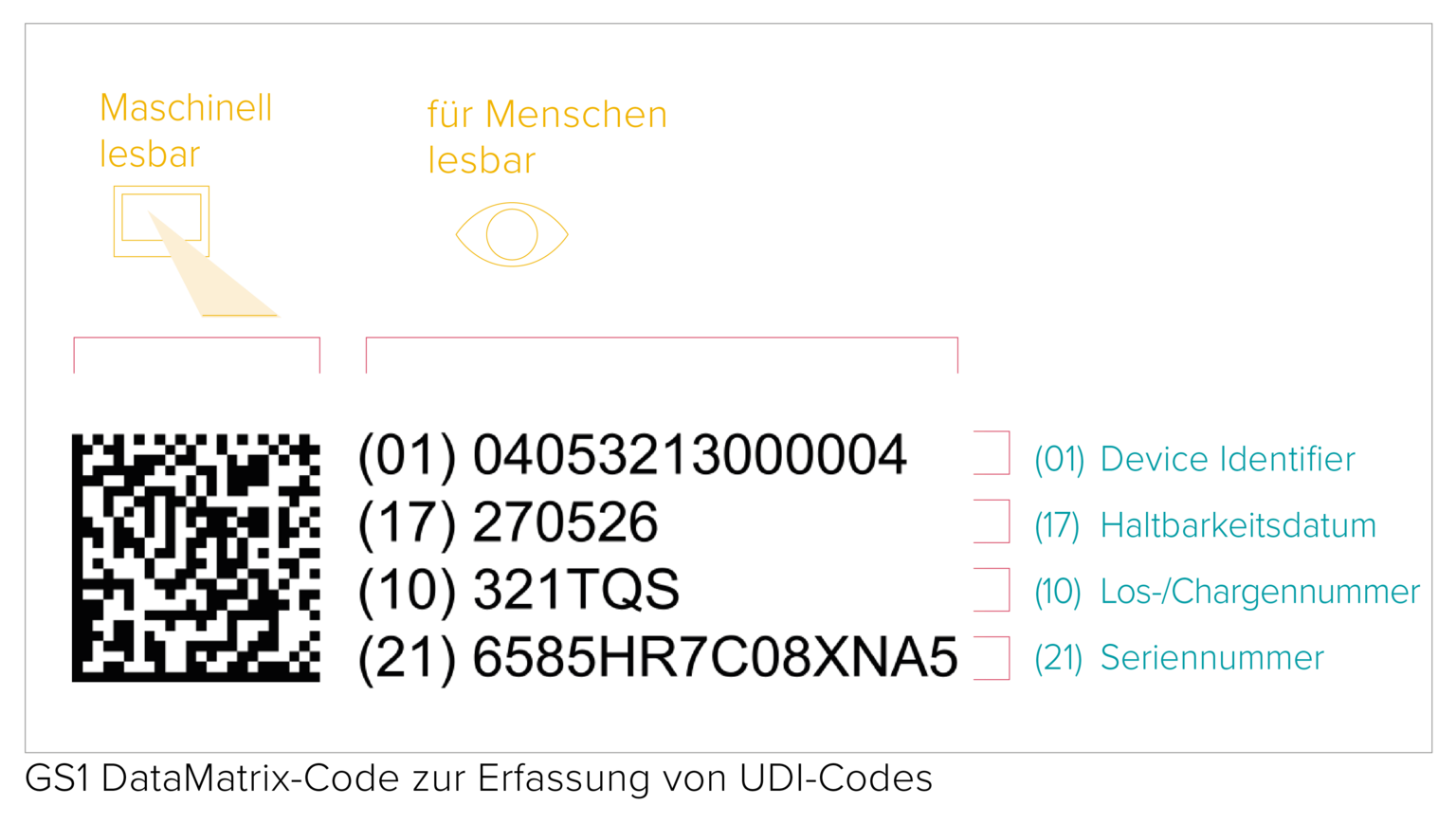
Jeder UDI Code besteht aus einem maschinenlesbaren Code (AIDC) und einem für Menschen in Klarschrift verfassten Code (HRI). Der AIDC kann ein Strichcode/Barcode oder auch ein DataMatrix-Code usw. sein. Die UDI Vorschriften der EU MDR legen zudem fest, dass der UDI Code bei wiederverwendbaren Produkten direkt auf dem Produkt selbst oder auf dem Etikett und allen höheren Verpackungsebenen anzugeben ist.
Die Druckqualität eines Barcodes hängt von einer ganzen Reihe verschiedener Faktoren ab, die mit der Qualität und den Lagerbedingungen der Verpackungsmaterialien zusammenhängen. Obwohl keine spezifischen Vorschriften für die Prüfung von UDI Barcodes existieren, fordert die GS1 die Einhaltung der ISO/IEC-Verifizierungsstandards, um die Lesbarkeit der Barcodes für alle Beteiligten der Wertschöpfungskette zu gewährleisten.
Registrierung und Aktualisierung der UDI Daten in EUDAMED
Die Europäische Datenbank für Medizinprodukte (EUDAMED) ist eine zentrale europäische Datenbank zum Sammlen, Aktualisieren und Austauschen von Informationen über medizinische Geräte. EUDAMED soll als Anlaufstelle für Aufsichtsbehörden, Wirtschaftsteilnehmer, Gesundheitsdienstleister und die Öffentlichkeit dienen.
Zeitlicher Rahmen zum Erreichen der UDI Compliance
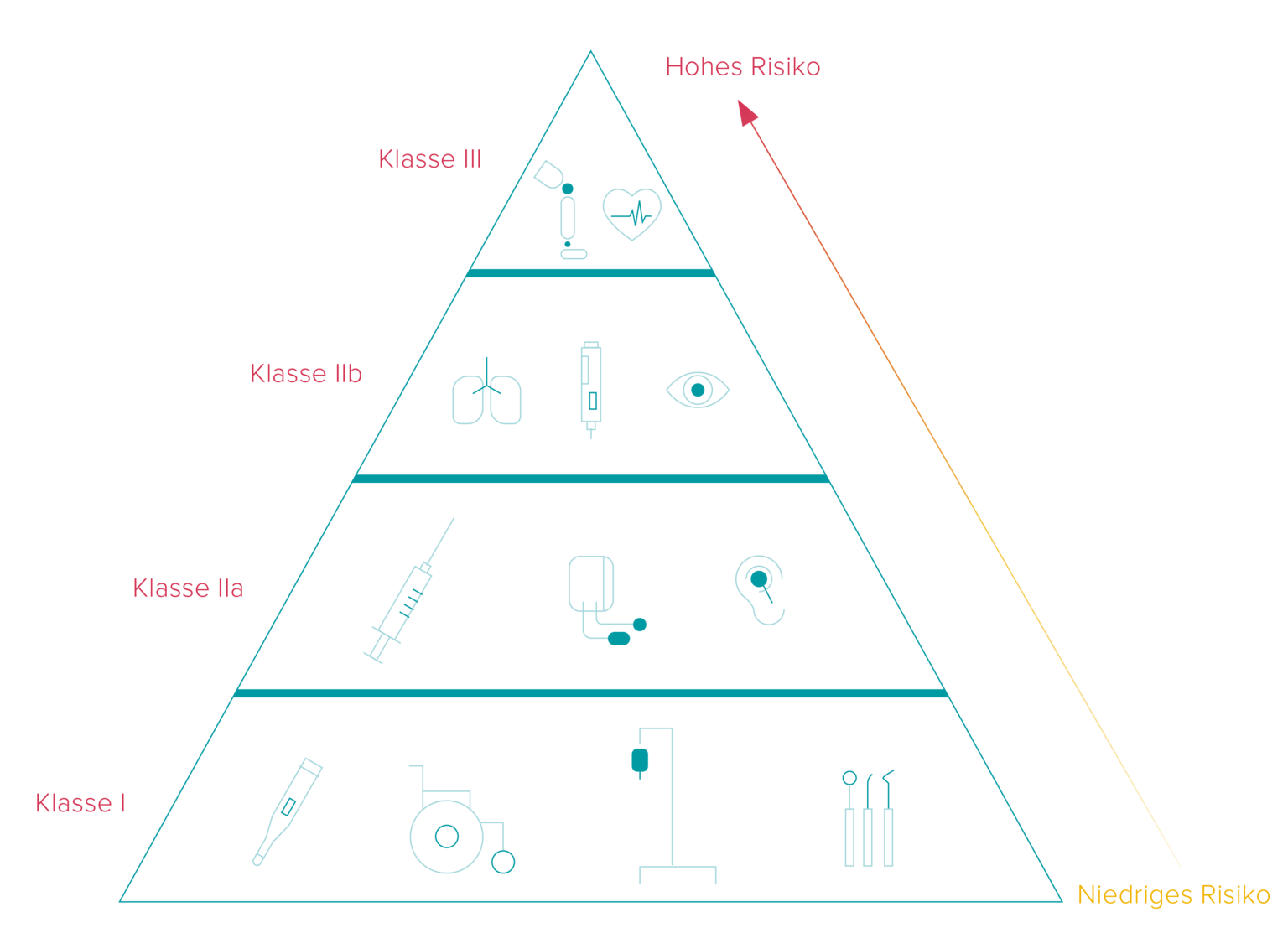
Die Fristen bezüglich der Umsetzung der UDI Vorschriften sind, je nach Risikoniveau, in drei Klassen aufgeteilt. Der Zeitrahmen für die Umsetzung hängt davon ab, ob der Hersteller den UDI Code auf das Produkt selbst oder auf ein Etikett aufbringt.
Möchten Sie als Hersteller von Medizinprodukten mehr über die UDI Vorschriften erfahren?
UDI Vorschriften aus globaler Sicht
Um eine Rückverfolgbarkeit von Medizinprodukten zu gewährleisten und Fälschungen sowie Produktumleitungen zu verhindern, haben die USA als erstes Land der Welt ein weltweit gültiges UDI System für auf dem US-Markt vertriebene Medizinprodukte eingeführt.
Die UDI Vorschriften der US-amerikanischen Behörde für Lebens- und Arzneimittelüberwachung („Food and Drug Administration“ – FDA) basieren weitestgehend auf den Richtlinien des International Medical Device Regulators Forums (IMDRF). Diese sehen eine zentralisierte nationale Datenbank (GUDID) vor, die zugleich ein öffentlich zugängliches Verzeichnis aller mit einer Identifizierungsnummer ausgestatteten Produkte darstellt.
Auch viele Schwellenländer haben die Tragweite der UDI Kennzeichnung bereits erkannt, darunter China, Indien, Brasilien, Südkorea, Saudi-Arabien und Taiwan – um nur einige zu nennen. Diese zusehends globale Reichweite wirkt sich wiederum unmittelbar darauf aus, wie große internationale Hersteller ihre Produkte kennzeichnen und UDI-Datenflüsse über verschiedene Regionen hinweg verwalten.
Entgegen den Bemühungen des IMDRF, die Entwicklung weltweit einheitlicher UDI Standards voranzutreiben, unterscheiden sich die Systeme der einzelnen Länder nach wie vor in vielerlei Hinsicht. Die Unterschiede können dabei unter anderem folgende Aspekte betreffen:
- Anerkannte Formate der UDI Datenträger
- Anbringung und Platzierung des UDI Codes auf der Ware bzw. der Verpackung
- Zusammensetzung der UDI-DI- und UDI-PI-Datensätze
- Durchführungsfristen für verschiedene Produktgruppen
- Ereignisse, die eine Aktualisierung der UDI Daten erforderlich machen
- Festlegungen von Produktgruppen, die den UDI Anforderungen mehrerer Länder unterliegen
Alle genannten Aspekte haben erheblichen Einfluss auf die Frage, welche UDI Compliance Lösung zu wählen ist, denn diese muss (angesichts der sich weltweit im Fluss befindlichen Regulierungen) in hohem Maße anpassungsfähig, zukunftssicher und agil sein.
Serialisierung von Medizinprodukten
Die Serialisierung ist für jedes effiziente System der Rückverfolgbarkeit von Medizinprodukten von grundlegender Bedeutung. So ist die Serialisierung nach der UDI für aktive implantierbare Produkte vorgeschrieben, zum Beispiel Herzschrittmacher, Defibrillatoren oder Glukosemonitore.
Allgemein erhält jedes Endprodukt bei der Serialisierung eine individuelle Seriennummer, damit die Ware (z. B. an der Kasse) automatisch identifiziert werden kann. Die Pharmabranche greift bereits weltweit auf die Serialisierung als Maßnahme gegen Fälschungen zurück. Auch in anderen Bereichen gewinnt diese Technologie immer mehr an Bedeutung.
Selbst Unternehmen, deren Produkte nicht in die Kategorie der aktiven implantierbaren Medizinprodukte fallen, profitieren in ihren Produktionslinien von flexiblen Technologien, durch deren Einsatz sowohl UDI Compliance als auch Serialisierung möglich ist. Dieser Ansatz hilft ihnen dabei, ihre Produktionslinien zukunftsfähig zu halten. Das zahlt sich besonders dann aus, wenn die UDI Anforderungen die Serialisierung zukünftig für weitere Produktgruppen vorschreiben oder die Serialisierung in bestimmten Importländern gefordert wird.
Aggregation der Medizinprodukte
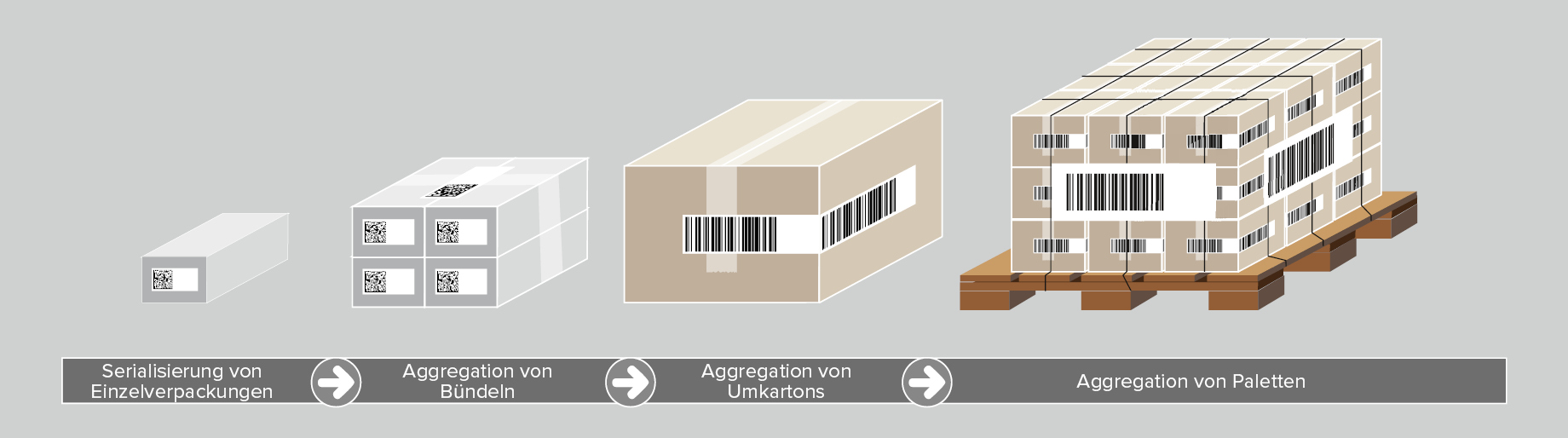
Obwohl sie in den UDI Vorschriften nicht näher ausgeführt wird, ist die Aggregation der Medizinprodukte eine weitere Säule der optimalen Rückverfolgbarkeit von Medizinprodukten. Aggregation bezieht sich dabei auf die Bildung von „Eltern-Kind-Beziehungen“ zwischen den verschiedenen Verpackungsebenen, beginnend bei einer einzelnen Einheit bis hin zu ganzen Paletten. Sollen beispielsweise mehrere Produkteinheiten in einem Versandkarton aggregiert werden, ist der Ablauf wie folgt:
- Der UDI Barcode jedes Produktes wird gescannt
- Die Daten der Barcodes werden aggregiert (gesammelt) und mit dem Versandkarton verbunden
- Der Versandkarton erhält ein Etikett mit einem UDI Barcode, einschließlich einer individuellen Seriennummer
Dieser Vorgang kann auf allen Verpackungsebenen wiederholt werden. Dadurch stehen beim Scannen eines Codes alle UDI Daten zur Verfügung, die die im Versandkarton enthaltenen Medizinprodukte betreffen.
Vorteile der Aggregation bei Rückrufaktionen
Die Aggregation verbessert nicht nur die Rückverfolgbarkeit von Medizinprodukten, sondern kann auch Rückruf-, Korrektur- oder Entfernungsprozesse des Herstellers optimieren. Wenn ein Produktrückruf oder eine Rücknahme unvermeidlich sind, sehen sich Unternehmen ohne Aggregation gezwungen, die gesamte Charge an allen Orten aus dem Umlauf nehmen.
Wenn ein Unternehmen jedoch durch die Aggregation der Medizinprodukte eine „Eltern-Kind-Beziehungen“ zwischen den Verpackungsebenen geschaffen hat, ist eine zielgerichtetere und sogar stückbezogene Produktrücknahme möglich. Die Produkte können dann anhand ihrer Seriennummer gezielt gefunden werden, was viel schnellere und genauere Rückruf- sowie Rücknahmemaßnahmen (als über die Chargennummer) ermöglicht.
Haben Sie weitere Fragen zur Aggregation von Medizinprodukten?
UDI Technologien für die Rückverfolgbarkeit von Medizinprodukten
Mit den TQS-Features von Wipotec ist die UDI Compliance sichergestellt. Darüber hinaus bieten die Features noch Zusatzvorteile. Je nach Produktions- und Verpackungsprozesses können Hersteller zwischen eigenständigen Maschinen oder OEM-Kits wählen. Beide Varianten erfüllen zuverlässig vielfältige Zwecke:
- UDI-konform kennzeichnen oder Codierungen auf mehreren Verpackungsebenen aufbringen. TQS-Anlagen bringen die UDI problemlos auf die Etiketten oder Verpackungen auf. Darüber hinaus ist es möglich, die UDI außerhalb der Linie auf flache Kartons aufzubringen, bevor die Geräte verpackt werden.
- Verifizieren und Einstufen des UDI Barcodes. Das TQS-System identifiziert zuverlässig alle Produkte, deren Barcodes nicht den gewünschten Standards entsprechen, und lehnt diese ab. So wird sichergestellt, dass nur lesbare Barcodes die Qualitätskontrolle bestehen. Darüber hinaus stuft das System jeden gedruckten Code gemäß dem GS1 Vorschriften für die Prüfung von UDI Barcodes ein. Die so gewonnenen Daten sind ein eindeutiger Beleg dafür, dass die gedruckten Barcodes an der Produktionsstätte den ISO/IEC-Qualitätsstandards entsprechen.
- Serialisieren und Aggregieren von Medizinprodukten. TQS-Lösungen sind multifunktionale, modulare Maschinen, die eine zuverlässige Rückverfolgbarkeit von Medizinprodukten ermöglichen und eine hohe Interoperabilität garantieren. Die Maschinen können selbstständig Seriennummern generieren, diese Nummern Produkten zuweisen und anschließend die Daten an das örtliche System übertragen.
- Die manipulationssichere Versiegelung erfolgt nach Überprüfung der Qualität des Codes. Dabei handelt es sich um ein optionales Modul, das sowohl für selbstständige Maschinen als auch für OEM-Kits erhältlich ist. Unabhängig von den UDI Anforderungen gewährleisten manipulationssichere Etiketten die Integrität der Verpackung.
- Offene Schnittstellen und Interoperabilität – Dank der offenen Schnittstellen können TQS-Systeme UDI Daten mit jedem vor Ort installierten System austauschen.
- Die Linien-Kontrollwägevorrichtung ist eine optionale Komponente, die eine hochpräzise Gewichtsanalyse der fertigen Produkte ermöglicht. Das Wägeergebnis zeigt genau an, ob die fertige Verpackung alles enthält, was sie enthalten soll. Produkte mit einem falschen Gewicht werden zurückgewiesen. Abweichungen vom Zielgewicht deuten für gewöhnlich auf eine fehlende Komponente hin, z. B. einen nicht enthaltenen Beipackzettel.
Eigenständige Maschinen oder OEM-Kits
Eigenständige Maschinen von Wipotec sind kompakte, anpassbare Plug-and-Play-Lösungen für eine UDI-konforme Codierung, Serialisierung und Aggregation der Medizinprodukte. Diese eigenständigen Systeme können schnell in vorhandene Verpackungsstraßen integriert werden. Das Portfolio umfasst zudem Lösungen für den Druck von UDI Codes abseits der Verpackungslinie und vor dem eigentlichen Verpacken.
TQS-OEM-Kits setzen sich aus mehreren Komponenten zusammen, etwa Druckern, Kameras und Etikettierern. OEM-Kits sind modular sowie flexibel und können ganz nach den Wünschen der Kunden konfiguriert werden. OEM-Kits werden in die Anlagen von Drittanbietern integriert, was sie zur bevorzugten Lösung an Standorten macht, an denen der Platz begrenzt ist. Dank vollautomatischer Prozessabläufe ermöglicht TQS-OEM sehr hohe Produktionsgeschwindigkeiten.
UDI Compliance und mehr: Nutzen Sie die Vorteile der Spitzenlösungen
In Hinblick auf die UDI Compliance erweist sich die TQS-Technologie nicht nur als intuitiv sowie einfach zu bedienen, sondern erhält auch die Gesamtproduktivität der Verpackungsstraßen. Zugleich bietet die Technologie wertvolle Smart Features, die die Effizienz weiter steigern und die Hersteller gleichzeitig bei der Einhaltung der UDI Vorschriften unterstützen.
TQS Smart Features:
- Zentrales Linienmanagement entlastet den Arbeiter an der Maschine, da er nicht jede Maschine oder ihre Komponenten einzeln einrichten muss. Alle relevanten Einstellungen können über die Linien-Management-Software zentral vorgenommen werden.
- ConfigureFast ist ein Feature, das eine schnelle sowie intuitive Einstellung und spätere Bedienung der Codier- und Prüfkomponenten ermöglicht. Das alles erfolgt über eine einzige Benutzeroberfläche.
- Offene XML-Schnittstellen gewährleisten die Kompatibilität mit über 80 Systemen auf Betriebsebene (L3 + L4) zum Zwecke der Datenverwaltung und -übertragung.
- TQS Traceability+ ermöglicht das Erfassen von zusätzlichen Daten, wie z. B. von Code-Einstufungswerten oder des Produktgewichtes. Diese Daten können danach auf vielfältige Art und Weise genutzt werden, um die Produktionsqualität nachzuvollziehen.
- Abgesicherter Remote-Service über eine VPN-Verbindung via Firewall erlaubt einen schnellen Fernwartungsservice, der die Maschinenausfallzeiten und die Servicekosten erheblich senkt.
- Layout Software Interface gehört zu den neusten Features. Damit können Layouts mithilfe jeder externen, auf dem Markt erhältlichen Layout-Management-Software direkt vor Ort auf einem Computer gestaltet werden.
Nutzen Sie das Experten-Know-how von Wipotec
Wipotec zählt international zu den führenden Anbietern von zuverlässigen Codierungs-, Serialisierungs- sowie Aggregationslösungen und unterstützt damit die Hersteller von Medizinprodukten bei der Compliance hinsichtlich der UDI Anforderungen. Seine technische Kompetenz hat das Unternehmen bereits bei mehr als 3.000 erfolgreichen Track & Trace-Projekten eindrucksvoll unter Beweis gestellt. Als GS1-Partner verfolgt Wipotec die regulatorischen Entwicklungen in aller Welt und bietet zahlreiche Funktionen an, die die Einhaltung aller aktuellen sowie zukünftigen weltweiten Vorschriften ermöglichen.