Implementação dos requisitos de UDI com tecnologia modular e flexível
Considerando as perdas multimilionárias de receita devido à falsificação e ao desvio de produtos todos os anos, a implementação dos requisitos de UDI em nível internacional é uma medida muito necessária para reduzir os riscos relacionados a fraudes e melhorar o fluxo de dados e a transparência entre todas as partes interessadas relevantes em todas as fronteiras.
Apesar dos desafios de curto prazo enfrentados pelos fabricantes de dispositivos, como os custos consideráveis de conformidade e a complexidade organizacional, o sistema de Identificação Única de Dispositivos (UDI) e a rastreabilidade de dispositivos médicos poderão trazer ganhos de longo prazo devido à mitigação da falsificação, à prevenção de importações paralelas e ao maior controle e transparência dos dados.
Artigo técnico: Conformidade à prova de obsolescência: uma perspectiva global sobre a identificação exclusiva de dispositivos
Acesso rápido a informações sobre o produto, melhor gerenciamento de recall, proteção aprimorada contra falsificação e mercados cinza — espera-se que a Identificação Única de Dispositivos (UDI) de dispositivos médicos revolucione o setor de dispositivos médicos. Ao mesmo tempo, isso levanta várias questões e gera várias preocupações para os fabricantes de produtos e as empresas de rotulagem. É importante não perder de vista a perspectiva global, que envolve levar em consideração todos os desenvolvimentos e mudanças relacionados à UDI.
Saiba mais sobre os desafios da implementação da UDI e os fatores de sucesso de uma perspectiva global neste artigo técnico. O documento oferece uma visão geral global dos últimos desenvolvimentos no cenário internacional para fabricantes de produtos e empresas de rotulagem. Por isso, é uma fonte valiosa de informações para fabricantes internacionais de produtos e empresas de rotulagem.
Os fundamentos do sistema de identificação exclusiva de dispositivos da UE
Com o objetivo de aderir aos requisitos de UDI e suas datas de aplicação, as empresas de dispositivos médicos passam pela fase de implementação, que envolve a atualização das linhas de embalagem com novas tecnologias e a integração de soluções adicionais de TI. De acordo com o MDR e o IVDR da UE, os fabricantes de dispositivos médicos serão totalmente responsáveis por executar as seguintes etapas:
Atribuição de UDIs a produtos individuais
Com pouquíssimas exceções, qualquer dispositivo médico colocado no mercado deve receber um Identificador Exclusivo de Dispositivo (UDI) que consiste nos seguintes dados:
- um identificador de dispositivo (UDI-DI) com informações fixas sobre o fabricante e o dispositivo;
- um identificador de produção (UDI-PI) com dados de produção variáveis, como um número de série ou de lote, data de fabricação e data de validade.
No entanto, os requisitos de UDI não obrigam os fabricantes a gerar dados de UDI-DI, pois eles os receberão de uma das agências emissoras autorizadas — GS1, HIBCC, ICCBBA ou IFA — que eles podem escolher livremente.
Colocação do código UDI em um produto e em sua embalagem
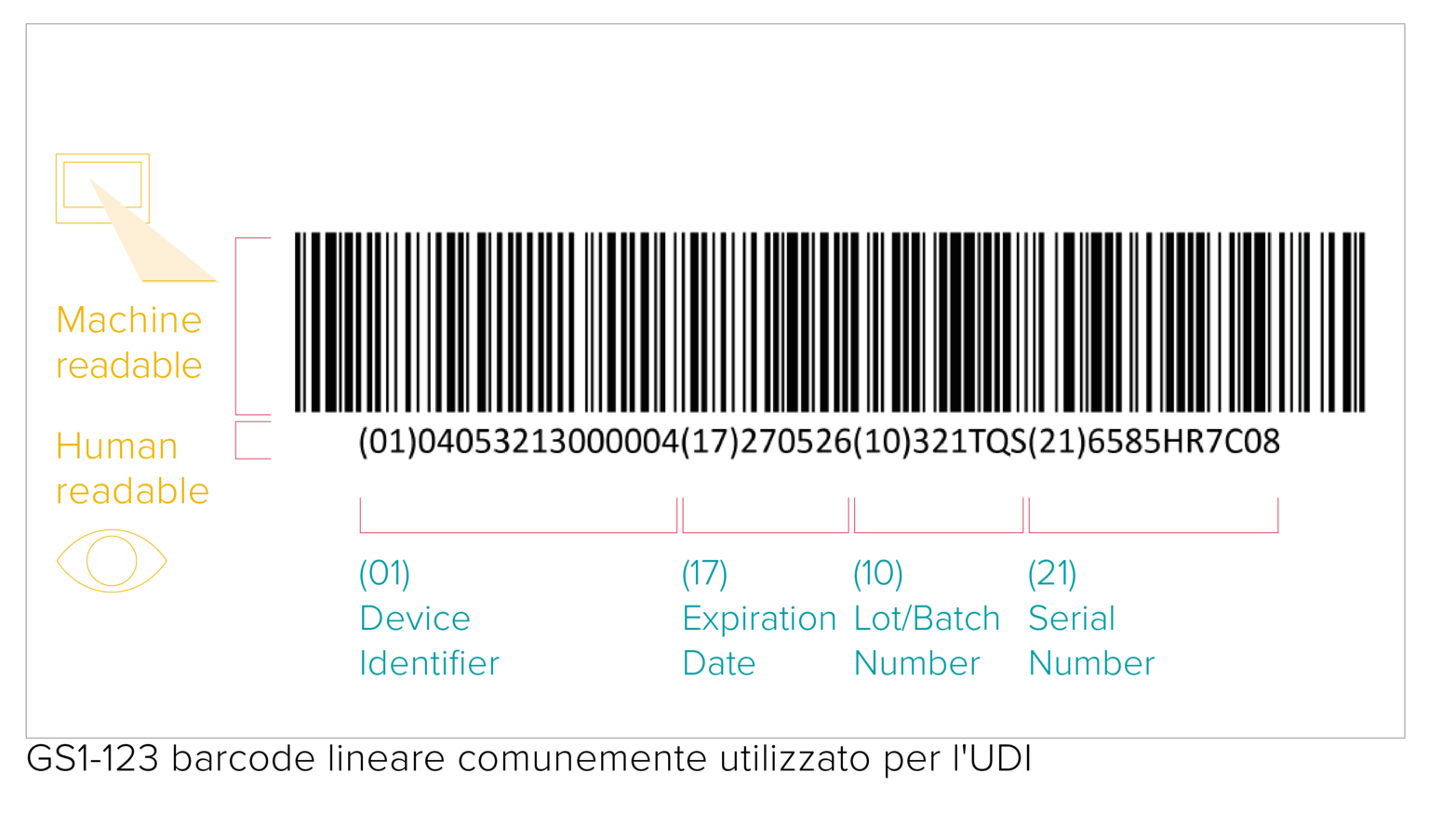
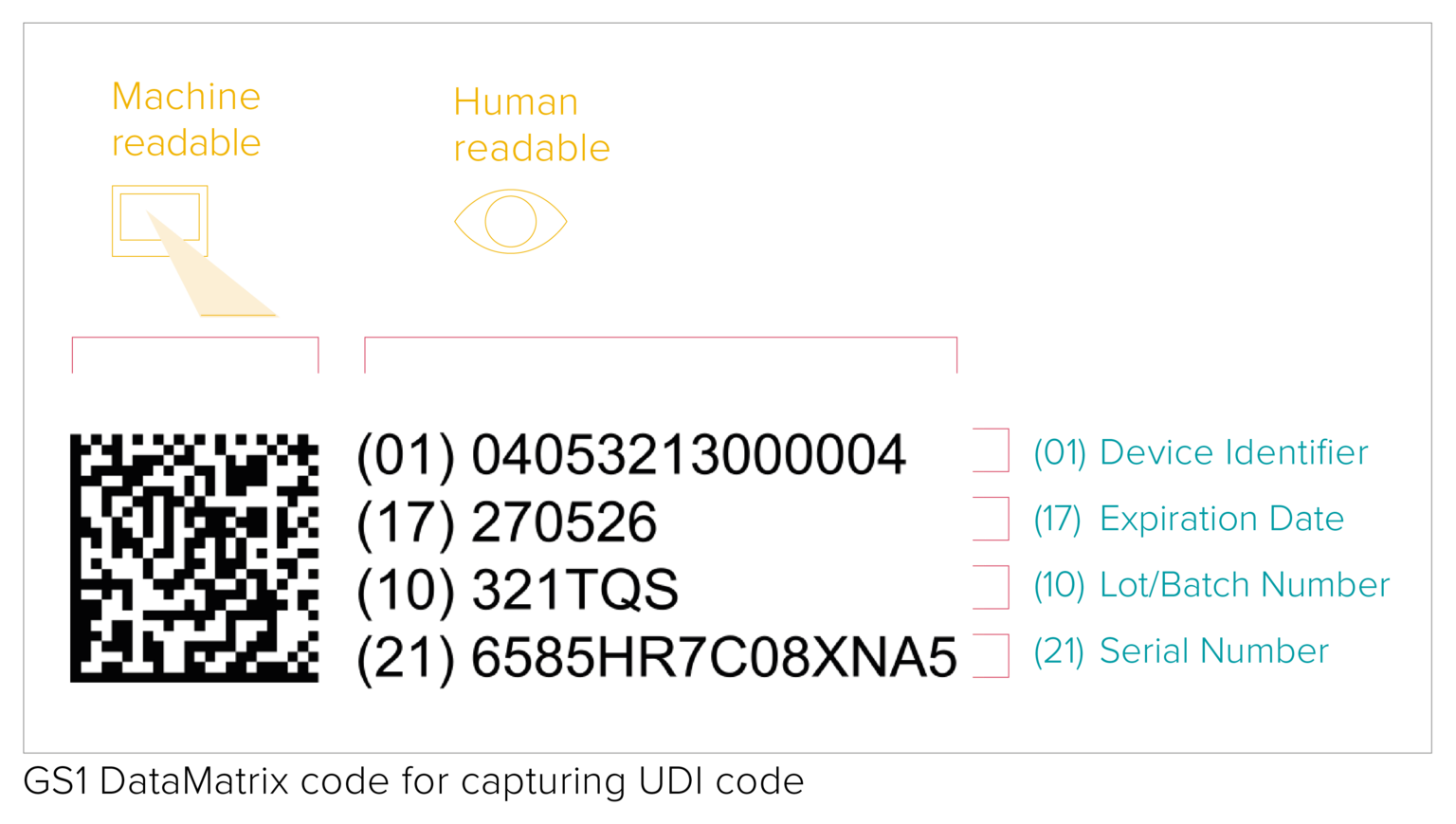
O código UDI representa um código legível por máquina (AIDC) e por humanos (HRI). AIDC significa Identificação Automatizada para Captura de Dados e pode ser um código de barras linear, um DataMatrix etc. Conforme especificado pelos requisitos da UDI, o código da UDI deve ser marcado diretamente no dispositivo, no caso de produtos reutilizáveis, ou colocado em seu rótulo e em todos os níveis superiores de embalagem.
A qualidade da impressão do código de barras depende de vários fatores diferentes relacionados à qualidade e às condições de armazenamento dos materiais de embalagem. Embora não haja requisitos específicos de verificação do código de barras UDI, a GS1 solicita a adesão aos padrões de verificação ISO/IEC para garantir a legibilidade do código de barras por todas as partes interessadas da cadeia de suprimentos.
Registro e atualização de dados de UDI no EUDAMED
O EUDAMED, um banco de dados europeu interoperável atualizado para coleta, renovação e troca de informações sobre dispositivos médicos, servirá como ponto de acesso para órgãos reguladores, operadores econômicos, prestadores de serviços de saúde e o público.
Cumprir o cronograma de conformidade com a UDI
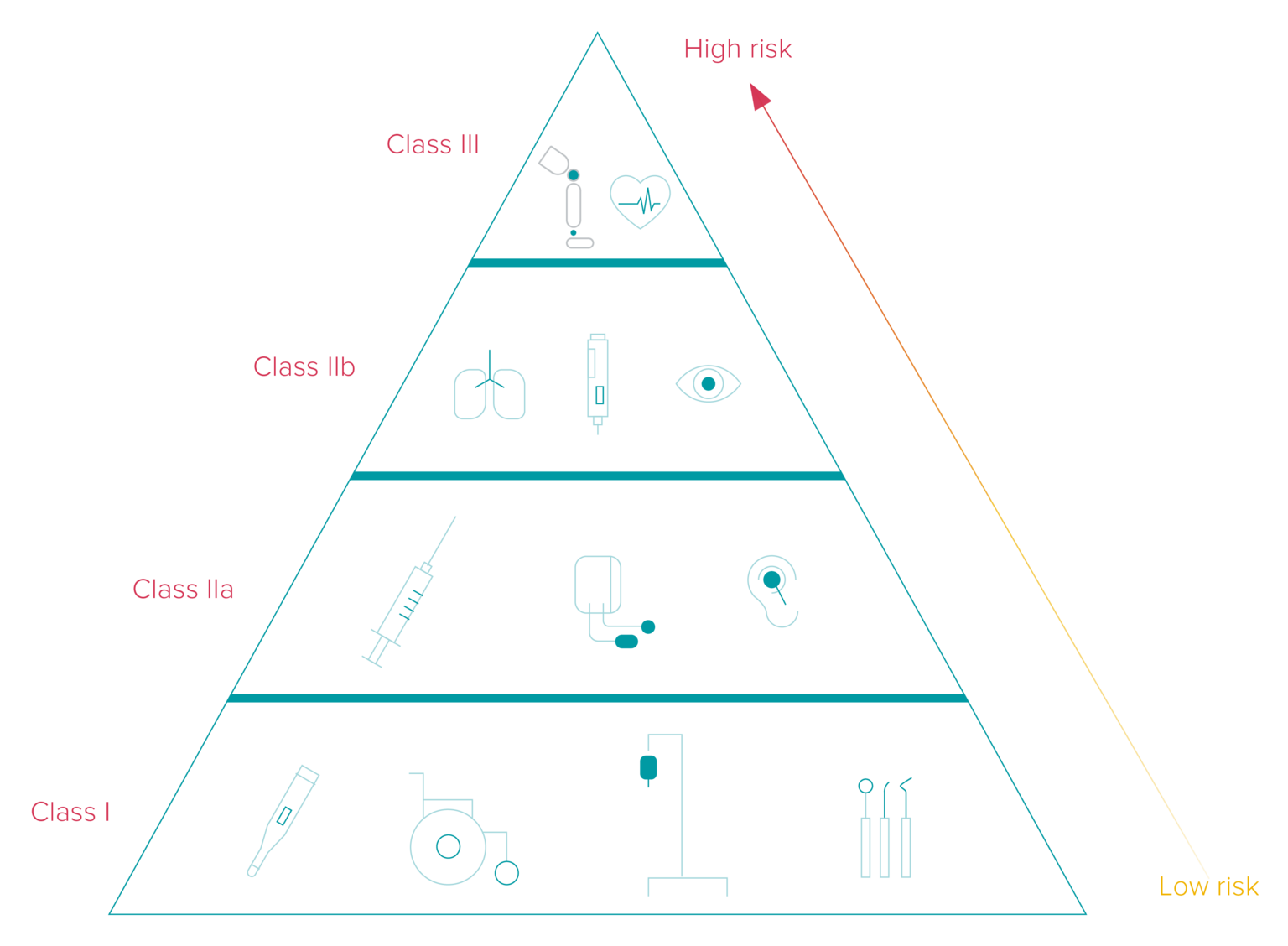
Os prazos de implementação da UDI diferem com base na classificação dos dispositivos médicos e de diagnóstico in vitro em três categorias diferentes, correspondentes aos seus níveis de risco. Além disso, o prazo depende do fato de o fabricante colocar o código UDI no próprio dispositivo ou em seu rótulo.
Você gostaria de saber mais sobre os requisitos de UDI para fabricantes de dispositivos médicos?
Requisitos de UDI sob a perspectiva global
Para possibilitar o rastreamento de dispositivos médicos e evitar o desvio e a falsificação de produtos, os EUA foram o primeiro país a introduzir um sistema global de UDI para dispositivos médicos distribuídos em seu mercado.
Os requisitos de UDI da FDA são, em sua maior parte, baseados na orientação do International Medical Device Regulators Forum (IMDRF) com um banco de dados nacional centralizado, o GUDID, que serve como um catálogo de referência pública para produtos codificados com UDI.
A importância da identificação exclusiva de dispositivos também foi reconhecida em vários países dos mercados emergentes, incluindo China, Índia, Brasil, Coreia do Sul, Arábia Saudita e Taiwan, para citar apenas alguns. Esse desenvolvimento global tem um impacto direto na forma como os fabricantes internacionais marcam seus produtos e gerenciam os fluxos de dados de UDI em diferentes regiões geográficas.
Apesar dos esforços do IMDRF para ajudar a padronizar os requisitos de UDI globalmente, eles diferem de país para país de várias maneiras. Essas diferenças podem incluir os seguintes aspectos:
- Tipos aceitos de formatos de suporte UDI
- Marcação e colocação do código UDI no produto e em sua embalagem
- Requisitos de dados UDI-DI e UDI-PI
- Prazos de aplicação para diferentes grupos de produtos
- Eventos que acionam uma atualização de dados UDI
- Grupos de produtos sujeitos a requisitos de UDI em diferentes países
Esses aspectos têm um impacto significativo na escolha de uma solução de conformidade com a UDI que, dada a evolução das regulamentações globais, precisa ser altamente adaptável, ágil e à prova de obsolescência.
Serialização de dispositivos médicos
Embora seja fundamental para qualquer sistema eficiente de rastreabilidade de dispositivos médicos, a serialização também é um requisito da UDI para dispositivos implantáveis ativos, por exemplo, marca-passos, desfibriladores e monitores de glicose. A serialização refere-se à atribuição de um número de série exclusivo a cada produto acabado para que ele possa ser identificado automaticamente no ponto de venda.
O setor farmacêutico já está implantando a serialização como uma medida antifalsificação em nível global, e essa tecnologia também está ganhando força em outros setores. Mesmo as empresas cujos produtos não se enquadram na categoria de dispositivos implantáveis ativos se beneficiarão ao equipar suas linhas com tecnologia flexível que possibilita a conformidade com a UDI e a serialização.
Essa abordagem vai ajudar a manter suas linhas de produção prontas para o futuro, caso a serialização se torne um requisito imperativo de UDI para mais grupos de produtos ou seja obrigatória em determinados países importadores.
Agregação de dispositivos médicos
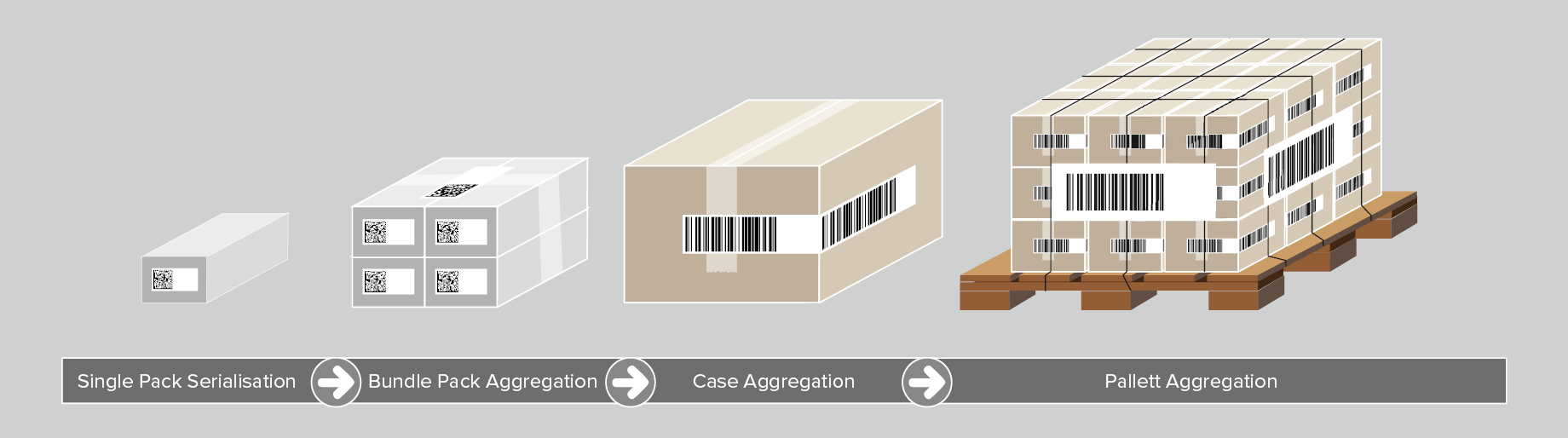
Embora não seja obrigatória pelos requisitos de UDI, a agregação de dispositivos médicos é outro pilar da rastreabilidade ideal de dispositivos médicos. A agregação refere-se à criação de uma hierarquia parent-child entre diferentes níveis de embalagem do produto, começando por uma unidade de produto até um palete. Por exemplo, para agregar várias unidades de produto em um caso de remessa, são realizadas as seguintes etapas:
- Um código de barras UDI para cada produto é escaneado.
- Os dados do código de barras são agregados e vinculados à caixa de remessa.
- A caixa de remessa recebe seu rótulo com um código de barras UDI, incluindo um número de série exclusivo.
Esse processo pode ser repetido para todos os níveis de embalagem. Ao ler um código, o operador recebe todas as informações de UDI relacionadas aos dispositivos médicos contidos na caixa de remessa.
Benefícios da agregação durante recalls de produtos
A agregação de produtos não apenas aprimora a rastreabilidade de dispositivos médicos, mas também pode otimizar os processos de recall, correção ou remoção de produtos. Se o recall ou a retirada de um produto é inevitável, os fabricantes são obrigados a retirar todo o lote de produtos de circulação em todos os locais.
Como a agregação de dispositivos médicos cria hierarquias entre os níveis de embalagem, ela possibilita retiradas de produtos mais direcionadas e até mesmo baseadas em unidades. Isso significa que os produtos podem ser recolhidos ou removidos com base em números de série em vez de números de lote. Essa nova opção leva a um processo de retirada ou recall de produtos muito mais rápido e direcionado.
Você tem dúvidas sobre a agregação de dispositivos médicos?
Tecnologia UDI para rastreabilidade de dispositivos médicos
As soluções TQS da Wipotec possibilitam efetivamente a conformidade com a UDI e fornecem valor adicional por meio de um conjunto de várias opções adicionais. Dependendo de vários aspectos do processo de produção e embalagem, os fabricantes podem optar por máquinas autônomas ou kits OEM. Ambas as soluções podem funcionar de maneira confiável:
- Rotulagem ou codificação em conformidade com a UDI em vários níveis de embalagem. Seja de maneira autônoma ou OEM, o equipamento TQS pode colocar identificadores de dispositivos exclusivos em rótulos de produtos e materiais de embalagem. Também é possível imprimir UDIs em caixas planas off-line, antes de embalar os dispositivos.
- Verificação e classificação de código de barras UDI. O sistema TQS identifica e rejeita de maneira confiável os produtos com códigos de barras de baixa qualidade para garantir que somente os códigos de barras legíveis passem pela verificação de qualidade. Além disso, o equipamento realiza a classificação de qualidade de cada código de barras impresso de acordo com os requisitos de verificação de código de barras UDI da GS1. Os dados de qualidade e classificação do código de barras são uma prova sólida de que os códigos de barras impressos correspondem aos padrões de qualidade ISO/IEC no ponto de fabricação.
- Serialização e agregação de dispositivos médicos. As soluções TQS são máquinas modulares multifuncionais que possibilitam a rastreabilidade confiável de dispositivos médicos. Além da interoperabilidade perfeita, as máquinas podem gerar e atribuir números de série aos produtos de maneira autônoma e transferir dados para o sistema do local.
- A vedação inviolável é realizada após a verificação da qualidade do código. Esse é um módulo opcional que está disponível em soluções OEM e autônomas. Embora não seja um requisito da UDI, os rótulos invioláveis garantem a integridade da embalagem do produto.
- Interfaces abertas e interoperabilidade. Graças às interfaces de comunicação abertas, o equipamento TQS pode trocar dados UDI com qualquer sistema em nível de local.
- Controle de peso em linha é um componente opcional que possibilita a inspeção ultraprecisa do peso dos produtos acabados. Seus resultados de peso altamente precisos indicam se a embalagem acabada contém tudo o que deve conter. Os produtos com peso incorreto são rejeitados. O desvio do peso alvo geralmente significa um componente ausente, por exemplo, um folheto.
Máquinas autônomas e kits OEM
As máquinas autônomas da Wipotec são soluções compactas, personalizáveis e plug-and-play para codificação em conformidade com UDI, serialização e agregação de dispositivos médicos e que podem ser rapidamente integradas às linhas de embalagem. O portfólio também inclui soluções off-line para impressão de códigos UDI antes da embalagem.
Os kits OEM TQS são compostos por vários componentes, como impressoras, câmeras e rotuladores. Modular e flexível, uma solução OEM pode ser configurada com base nos requisitos específicos do cliente. O equipamento OEM é instalado em uma máquina de terceiros, o que o torna uma opção preferida em fábricas com menos espaço. Como uma solução totalmente automatizada, o OEM TQS pode operar em velocidades de produção muito altas.
Conformidade com UDI e muito mais: aproveite as vantagens das soluções de ponta
A tecnologia TQS para conformidade com UDI não é apenas intuitiva e fácil de operar, mas também mantém a produtividade geral das linhas de embalagem e oferece recursos inteligentes valiosos que aumentam a eficiência e ajudam os fabricantes a cumprir os requisitos de UDI.
Recursos inteligentes do TQS:
- O gerenciamento da linha central alivia o operador da máquina, pois ele não precisará configurar cada máquina ou seus componentes separadamente. Todas as configurações relevantes são definidas de maneira centralizada no software do gerenciador de linha.
- ConfigureFast possibilita a configuração e a operação rápidas e intuitivas dos componentes de codificação e inspeção por meio de apenas uma interface de usuário.
- Interfaces XML abertas garantem a compatibilidade com mais de 80 sistemas em nível local (L3 + L4) para gerenciamento e transferência de dados.
- O recurso Traceability+ do TQS possibilita a coleta de dados adicionais, como o valor de classificação do código e o peso do produto, a serem usados de várias maneiras para reproduzir a qualidade da produção.
- Serviço remoto seguro por meio de uma conexão VPN baseada em firewall possibilita um serviço remoto rápido, reduzindo o tempo de inatividade da máquina e os custos de serviço.
- A interface do software de layout é um dos recursos mais recentes. Ele possibilita a criação de layouts diretamente em um computador desktop por meio de qualquer software de gerenciamento de layout externo existente no mercado.
Use os conhecimentos especializados da Wipotec
Como fornecedora líder internacional de soluções confiáveis de codificação, serialização e agregação, a Wipotec dá suporte aos fabricantes de dispositivos médicos em seu caminho para a conformidade com os requisitos de UDI. A experiência tecnológica da empresa foi demonstrada em mais de 2000 projetos bem-sucedidos de Track and trace. Como parceira da GS1, a Wipotec acompanha os desenvolvimentos regulatórios globais e oferece vários recursos que possibilitam a conformidade com as regulamentações globais atuais e futuras.